新研究發現蛋白質MFSD1可以通過將癌細胞粘在周圍的組織上而阻止它們遷移
(神秘的地球uux.cn報道)據cnBeta:手術切除或化療可能被證明對消除最初的腫瘤有效,但往往癌細胞可以脫離並在身體周圍產生二次生長。這被稱為轉移性癌症,實際上是該疾病的主要死因,其促使人們對阻止擴散的方法展開了大量的研究。
現在,一項新研究發現了一個新的目標--一種蛋白質,它可以通過將癌細胞粘在周圍的組織上而阻止它們遷移。
雖然轉移性癌症的危險是眾所周知的,但不太清楚的是,為什麽有些病人在治療原發腫瘤後會出現轉移性癌症,而有些則沒有。揮之不去的癌細胞可以通過血液或淋巴管遷移到身體的其他部位進而形成新的腫瘤,這項新研究的作者正在試圖通過一種名為MFSD1的蛋白質更多地了解並可能幹預這一過程。
由奧地利科學技術研究所和蘇黎世大學的科學家組成的研究小組此前通過對果蠅的實驗發現,這種蛋白質在細胞遷移中發揮了作用,。果蠅是生物醫學研究中最常用的模型之一,因為它們的生命周期很短,而且它們跟人類共享許多基因和生物功能。最新的研究集中在小鼠身上,科學家們設計了缺乏這種蛋白質的癌細胞。
這確實能使癌細胞比擁有該蛋白的癌細胞走得更快並表明MFSD1在細胞遷移中發揮著預防作用。研究團隊在患有乳腺癌、結腸癌和皮膚癌的活體小鼠身上觀察到了這種效果。
研究作者Daria Siekhaus指出:“在沒有MFSD1的情況下,轉移的情況強烈增加。”
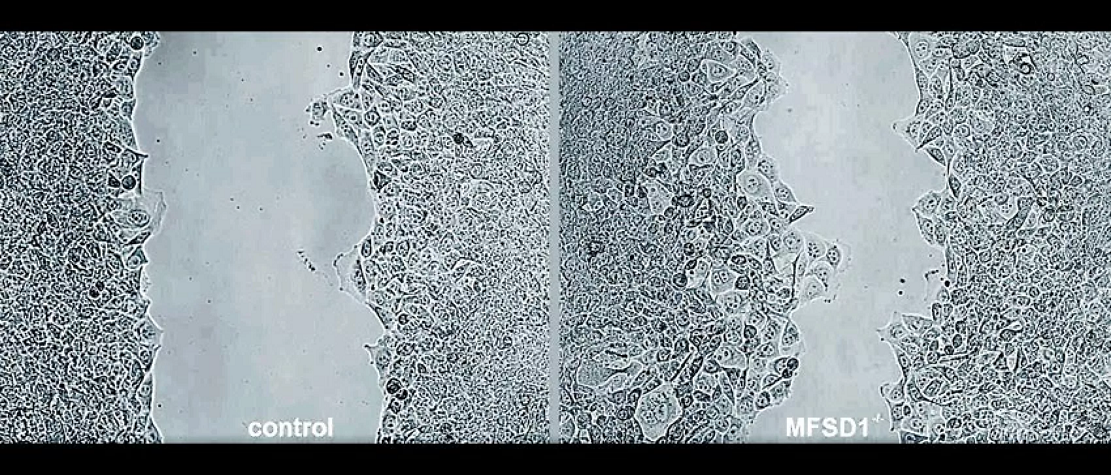
為了研究其中的原因,科學家們對含有和不含有MFSD1蛋白的癌細胞進行了一種壓力測試。這涉及到使用一個微小的橡膠工具將細胞從培養皿的表麵刮走,那些含有MFSD1蛋白的細胞由於機械壓力而迅速死亡。然而那些沒有該蛋白的細胞基本上保持完整,這使得研究小組得出結論,缺乏MFSD1的細胞可以更容易地進入並通過血液。
這項研究的論文第一作者Marko Roblek說道:“我們想知道為什麽較低的MFSD1水平除了允許它們更自由地移動之外還對腫瘤有利。比如當癌細胞在血液中旅行時,它們會經曆大量的機械壓力。”
通過觀察,研究小組發現,MFSD1通過維持細胞表麵被稱為整合素的受體而產生這些影響,這使得整合素能讓細胞相互粘連,同時還粘連到被稱為細胞外基質的密集的周圍網絡。因此,缺乏MFSD1的腫瘤細胞不那麽容易回收某些類型的整合素。
Siekhaus說道:“其結果是,細胞與周圍組織和彼此之間的粘附性降低使得它們更容易遷移。”
雖然實驗是在小鼠身上進行的,但該團隊還通過檢查癌症患者的數據探索了MFSD1在人類身上的作用。這顯示了該蛋白的水平和受試者的預後之間的相關性。
Roblek說道:“我們已經看到,患有特定形式的乳腺癌、胃癌和肺癌的患者,如果MFSD1的水平較低,那麽他們的預後會更差。高水平的MFSD1似乎是保護性的--它像腫瘤轉移的抑製劑一樣發揮作用。”
該團隊的發現為針對MFSD1的新形式治療奠定了基礎,有可能提高其水平以抑製轉移性癌症的擴散。有趣的是,科學家們還指出,如果他們能確定編碼MFSD1蛋白的基因,那麽它可以通過揭示癌症可能具有的侵略性來指導治療。
Siekhaus說道:“如果這個標誌物變得更加確定,醫生可以用它來幫助分類癌症的侵略性並決定不同的治療方案。”
相關報道:科學家開發新療法 可通過讓癌細胞“休眠”來防止腫瘤轉移
(神秘的地球uux.cn報道)據cnBeta:根據一項新研究,一種新的治療方法通過迫使癌細胞進入無法增殖的“休眠”狀態,防止小鼠轉移性腫瘤的生長。這項發表在《實驗醫學雜誌》(JEM)上的研究可能會帶來新的治療方法,防止各種癌症類型的複發或擴散,包括乳腺癌和頭頸鱗狀細胞癌(HNSCC)。
許多癌症患者複發,往往是在最初治療的幾年或幾十年後,並形成新的腫瘤,在同一部位重新生長或轉移(擴散)到身體的其他部位。這些繼發性腫瘤往往對治療有抵抗力,是由個別腫瘤細胞產生的,這些腫瘤細胞在重新激活開始增殖之前可能會保持長時間的“休眠”狀態。因此,如果研究人員能夠找到一種使剩餘的癌細胞處於“休眠”狀態的方法,就可以防止病人複發。
在之前的一項研究中,西奈山伊坎醫學院的Maria SOLEDad Sosa和阿爾伯特-愛因斯坦醫學院的Julio A. Aguirre-Ghiso發現,癌細胞保持“休眠”的能力是由一種叫做NR2F1的蛋白質控製的。 這種受體蛋白可以進入細胞核並打開或關閉許多基因,激活一個防止癌細胞增殖的程序。原發性腫瘤中的NR2F1水平通常較低,但在休眠的擴散性癌細胞中卻升高了。然後當癌細胞再次開始增殖並形成複發或轉移性腫瘤時,NR2F1蛋白的水平再次下降。
Aguirre-Ghiso解釋說:“因此,我們認為用一種小分子激活NR2F1可能是一種有吸引力的臨床策略,可以誘導癌細胞休眠,防止複發和轉移。”
在新的JEM研究中,Sosa和Aguirre-Ghiso的團隊使用了一種基於計算機的篩選方法來確定一種名為C26的藥物,它能激活NR2F1。 研究人員發現,用C26治療患者衍生的HNSCC細胞能提高NR2F1的水平並阻止細胞增殖。
研究人員隨後測試了C26是否會阻止小鼠的轉移。注射了患者來源的HNSCC細胞的動物通常會形成大的原發腫瘤,在手術切除原發腫瘤後擴散到肺部。用C26治療減少了原發腫瘤的大小,並且在手術後,進一步劑量的C26完全阻止了轉移性腫瘤的生長。相反,齧齒動物的肺部隻含有少數“休眠”的擴散性癌細胞,即使在停止治療後也無法增殖。
Sosa和Aguirre-Ghiso的團隊確定,通過激活NR2F1,C26迫使癌細胞進入一種長期的休眠狀態,其特點是基因活動的獨特模式。腫瘤顯示出類似基因活動模式的癌症患者往往會更長時間不複發,這表明用C26型藥物誘導這種休眠程序可能對人類有效。
Sosa說:“激活NR2F1的藥物可能對乳腺癌特別有用。與ER陰性腫瘤相比,NR2F1在ER陽性腫瘤中高度富集,激活NR2F1可能能夠抑製因抗雌激素療法而保持在該狀態的休眠癌細胞的蘇醒。然而,由於C26治療提升了NR2F1的水平,該方法也可能對其他受體蛋白水平本來就低的癌症有用。”
Aguirre-Ghiso說:“總的來說,我們的研究揭示了一種基於機製和合理設計的策略,利用NR2F1激活的休眠狀態作為防止轉移性複發的一種治療選擇。”
